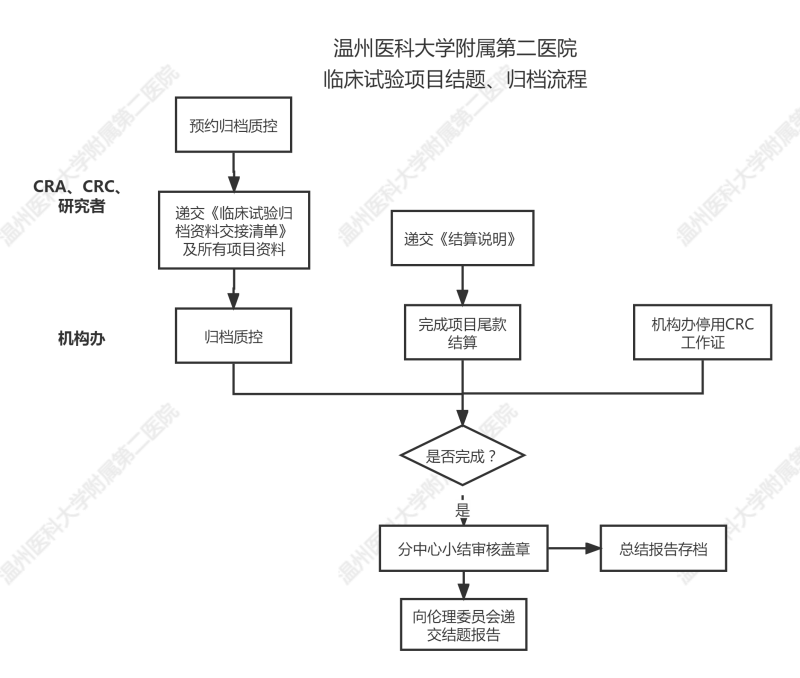
一、归档质控
研究者确认项目完成后,按我院《临床试验归档资料要求》递交归档资料至机构办。
机构办确认资料齐全后,在15天之内完成质控。
说明:
(1)建议归档质控时间:如为纸质CRF,必须处理毕归档质控问题后方可撕表;如为EDC,申请归档质控时间应在数据库锁库前。
(2)如遇特殊情况,质控时间将可能会有所延长,敬请见谅。
二、财务结算:详见《临床试验财务中期/尾款结算及退款流程”》
三、CRC工作证停用:机构对CRC电子工作证进行停用操作。
四、向机构办申请结题
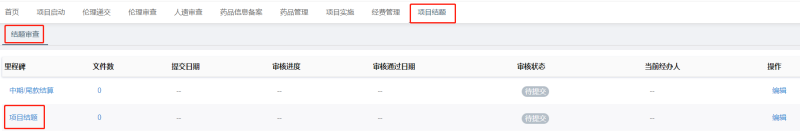
监查员在确认①归档质控问题处理完毕(与质控员沟通妥当);②尾款结算完毕;③CRC证件已归还后,
可在CTMS系统上向机构办申请结题,要求上传:1)财务结算说明(双方盖章版);2)分中心小结(初稿);
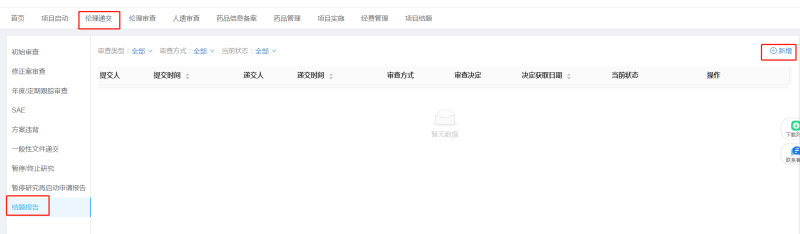
经机构办审查通过后,可递交纸质分中心小结至机构办盖章,本中心按照分中心小结盖章时间来计算结题/关中心时间,不强制要求递交关中心函。本分中心小结的模板不作强制要求,本院模板仅供参考。
*分中心小结完成盖章后,请配合伦理委员会完成项目结题审查。结题报告递交流程见参考《临床试验过程中文件递交流程》
五、总结报告审核盖章、存档
项目统计完成后,需递交总结报告至机构办及伦理委员会存档,递交流程参考《临床试验过程中文件递交流程》。
递交总结报告要求必须为纸质,不接受刻盘,组长单位及申办方盖章完整。
附件
1、《临床试验资料归档交接清单》----请至“医院官网-科研教学-新药研究-下载专区-《表格模板汇总》”下载
2、《结题报告》----请于“医院官网-科研教学-医学伦理-《GCP机构办立项的研究项目伦理审查申请》”下载
3、《分中心小结》---请至“医院官网-科研教学-新药研究-下载专区-《表格模板汇总》”下载