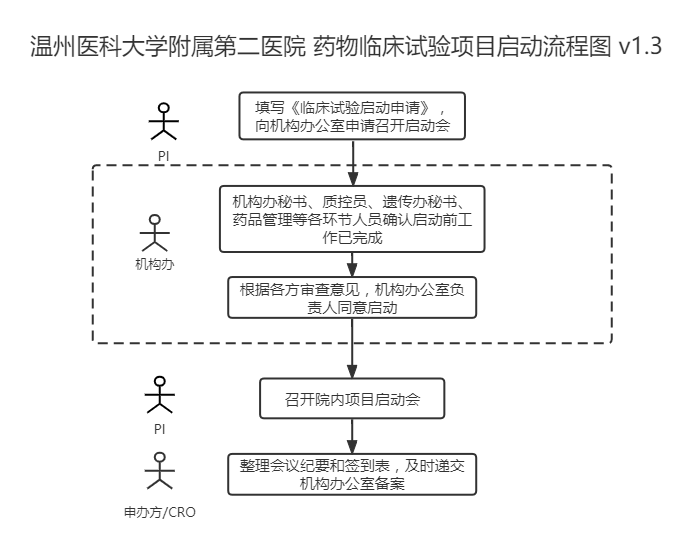
一、启动前工作准备
申办方/CRO监查员需按照《临床试验启动申请》要求提前完成启动前相关准备工作:
1、合同首笔研究经费到账并开具发票:流程见《临床试验研究费打款及开具发票流程》。
2、减免系统已完成维护:流程见《“临床试验受试者费用减免系统”使用流程》。
3、试验物资已到位:包括各种记录表、试验药物/器械、耗材等。
注:针对需要通过受试者筛选/入组后触发试验药物/器械的项目,需要提供关于触发机制的说明文件及SOP,告知具体的触发流程及触发后多久可以到位,确认受试者可以在方案要求的时间内取药,并且不会引发受试者额外的交通行程。
4、盲态/非盲CRA/CRC均已完成培训备案:流程见《CRC入职、变更、离职及管理流程》。
5、遗传资源审批/备案工作程序已完成:流程见《人类遗传资源管理相关办事指南》。
6、按要求完成各平台备案
(1)药物临床试验
根据浙江省局要求需完成浙江省监管平台信息备案:流程见《浙江省监管平台信息填报及更新流程》。
(2)医疗器械(含体外诊断试剂)临床试验
根据《医疗器械临床试验质量管理规范》要求,申办者所在地省、自治区、直辖市药品监督管理部门进行临床试验项目备案。
(3)国家全民健康保障信息平台医学研究登记备案信息系统备案
根据国家卫健委法规,要求我院承担组长单位的IIT项目和注册类项目应当在国家全民健康保障信息平台医学研究登记备案信息系统(https://www.medicalresearch.org.cn/login)上完成信息登记,PI可联系我院科研部陈建获取填报账号。要求格式如图。
7、临床试验准备阶段资料递交完整、版本正确。
8、已递交《监查计划》(语言不限,要求规定监查频率及监查内容,公司盖章红章件或项目经理签字)。
9、科学性审查(仅限IIT项目)
请项目组邀请2名高级职称专家对项目进行科学性审查(模板见附件),要求专家专业为研究所属专业或研究方法学相关领取,并将签字版扫描件上传至CTMS。
二、递交启动申请
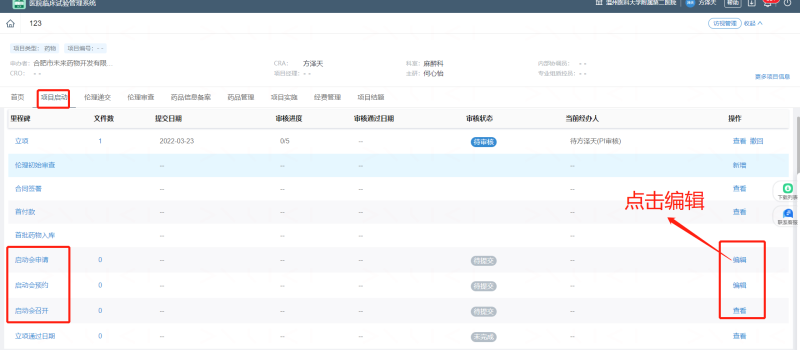
请申办方/CRO监查员至少提前一周在“太美eSite临床试验项目管理系统”上“启动会申请”中上传关于前期准备的证明文件,经PI、机构办质控员及主任审核同意召开启动会。
三、召开启动会
1、召开时间和地点
由研究者团队自行商定在“太美eSite临床试验项目管理系统”上“启动会预约”中填入具体的时间和地点,质控员审批后安排时间参会。
2、启动会内容
包括但不限于:介绍试验立项背景及试验的关键问题,讲解试验方案,讲解质量控制及质量保证,问题讨论及答疑等。
四、会后要求CRA在“太美eSite临床试验项目管理系统”上“启动会召开”中上传启动会会议纪要及签到表,递交机构办备案。
附件----请至“医院官网-科研教学-新药研究-下载专区-《表格模板汇总》”下载
1、《科学性审查备案表》